כימיה- חומרי לימוד
חידות מנעולים המודל החלקיקי:
השפה הכימית- מושגים חשובים
אטום - אבן הבניין של כל החומרים. זהו חלקיק קטן מאוד בגודל מליונית של מליונית המטר (גודלו נמדד בפיקומטר).
כיום מוכרים בעולם כ- 118 סוגי אטומים (יסודות) בלבד.
מולקולה - מספר מוגדר של אטומים (שניים לפחות) הקשורים ביניהם בקשר כימי במבנה מוגדר.
כל מולקולה מוגדרת ע"י סוג האטומים שממנה היא בנויה, מספר האטומים מכל סוג והמבנה המרחבי (הגיאומטרי) שלה.
כל החומרים בעולם בנויים מאטומים, אך לא כל החומרים בעולם בנויים ממולקולות (הגזים האצילים למשל, הם חומרים המורכבים מאטומים בודדים ולא כמולוקולות).
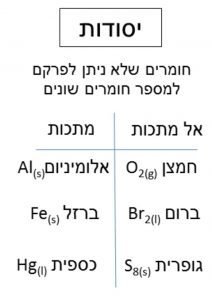
יסוד - חומר הבנוי מאטומים מסוג אחד בלבד. לא ניתן לפרק יסוד ולקבל חומר אחר.
תרכובת - חומר הבנוי ממספר סוגים שונים של אטומים (לפחות שניים) הקשורים ביניהם בקשר כימי. מכאן, שתרכובות הן חומרים שניתן לפרקם ליסודות המרכיבים אותם וכן לבנות אותן מאותם היסודות.
יסודות ותרכובות הם חומרים טהורים.
חומר טהור - חומר בעל הרכב כימי קבוע ותכונות פיזיקליות וכימיות המגדירות אותו, כגון: צבע, ריח, מצב צבירה בטמפרטורת החדר, נקודות היתוך ורתיחה ועוד.
תערובת - אוסף של מספר חומרים טהורים. (חומר טהור = יסוד או תרכובת).
ההבדל בין תערובת לתרכובת - סרטון בריינפופ.
סימול כימי - לכל יסוד שם משלו. כדי להקל על כתיבת שמות היסודות, הוחלט לתת להם סמלים. בדרך כלל מסמלים יסוד באמצעות האות הראשונה של שמו בלועזית כשהיא מסומנת באות גדולה. יש מספר יסודות ששמם מתחיל באותה האות לדוגמא: חנקן ונאון מתחילים באות N. במקרים אלו הוחלט לסמל יסוד אחד באות הראשונה של שמו ואת היסודות האחרים בשתיים או בשלוש האותיות הראשונות של שם היסוד, כאשר האות הראשונה היא אות גדולה והשנייה אות קטנה. לדוגמה : חנקן – N , נאון - Ne .
הטבלה המחזורית -
בשנת 1869 לאחר נסיונות רבים של מדענים שונים למיין את היסודות לקבוצות, הצליח החוקר הרוסי דימיטרי
מנדלייב לסדר את היסודות במבנה שאנו מכירים היום בשם "הטבלה המחזורית". בתקופתו של דימיטרי התגלו רק כ-60 יסודות. כידוע לכם, נכון להיום ידועים כבר כ-118 יסודות. מנדלייב רשם את שמות היסודות ואת התכונות שלהם על כרטיסיות ולבסוף הגיע לסידור שלהם בשורות לפי מספר אטומי עולה (מספר הפרוטונים בגרעין האטום). הסידור של דימיטרי מנדלייב מתאים עד היום ואפילו היה בו מקום ליסודות נוספים שיתגלו בעתיד.
כל שורה בטבלה המחזורית מייצגת מחזור.
כל טור בטבלה המחזורית מייצג משפחה.
לטבלה מחזורית אינטראקטיבית לחצו כאן. בקישור זה תוכלו לבחור אטום (יסוד) ולראות סרטונים אודותיו, לקרוא עליו ולקבל עליו מידע רב.
האטום:
האדם עוסק בחקר החומרים וניסיון להבין ממה החומר מורכב כבר שנים רבות ובכלל זה גם בחקר מבנה האטום.
בעבר, במסגרת חקר מבנה האטום, חשבו שהאטום הוא יחידת החומר הקטנה ביותר שאינה ניתנת לחלוקה, ומכאן נגזר שמו (יוונית: א=לא, טומוס=חלוקה).
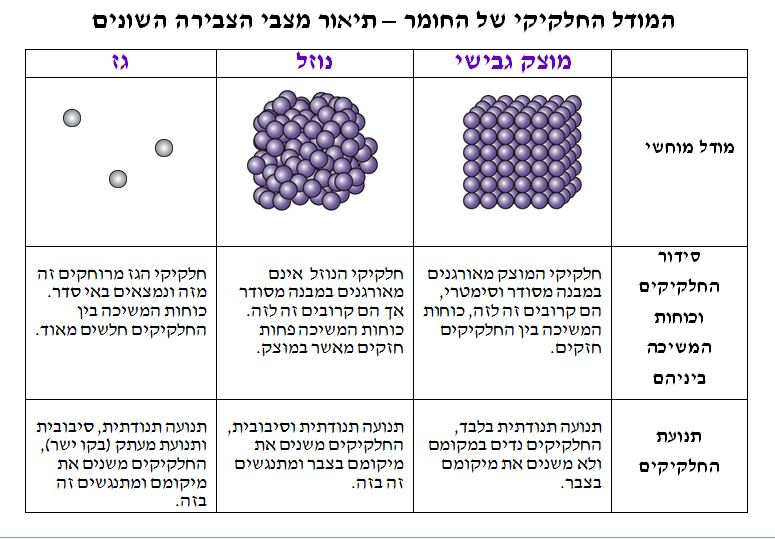
מאוחר יותר, התגלה שהאטום כן מכיל חלקיקים קטנים יותר: הגרעין ואלקטרונים מסביב לו, כשהגרעין מכיל בתוכו פרוטונים וניוטרונים.
כיום גם יודעים לומר שהניוטרונים והפרוטונים בנויים מחלקיקים קטנים יותר הקרויים קוורקים.
אטומים - הם חלקיקים הבסיסיים ביותר הבונים את החומרים.
יסודות- הם חומרים הבנויים מסוג אחד של אטומים. כמו: חמצן
מולקולה- שני אטומים או יותר המחוברים בינהם למשל: פחמן דו חמצני.
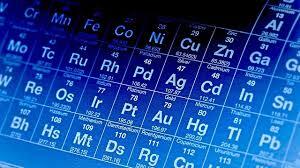
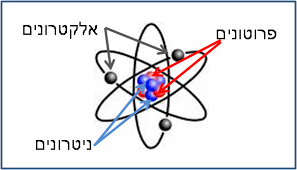
מבנה האטום: האטום מורכב מגרעין וסביבו ענן אלקטרונים. הגרעין הזעיר (בגודל של 1/100,000 מגודלו הכולל של האטום ובמשקל של מאית מהמשקל הכולל!), מכיל רכיבים שנקראים פרוטונים וניטרונים.
"ענן האלקטרונים" שמסביב לגרעין מכיל אלקטרונים שנעים בו, בתוך "ריק האטום", אזור ריק שתופס כמעט את כל נפח האטום (כ99.999% ממנו). בענן האלקטרונים מסודרים האלקטרונים מעין קליפות. ככל שהקליפה רחוקה מהגרעין, יש בה יותר אלקטרונים. האלקטרונים, מסתובבים מסביב לגרעין האטום במהירות עצומה.

מה זה אטום?
הסרטון הבא מציג את המודל הבסיסי, אשר הוצג לראשונה על ידי נילס בוהר (וזיכה אותו בפרס נובל) ומתאר את הרכב האטום ומאפייניו.
טבלה ובה פירוט החלקיקים:
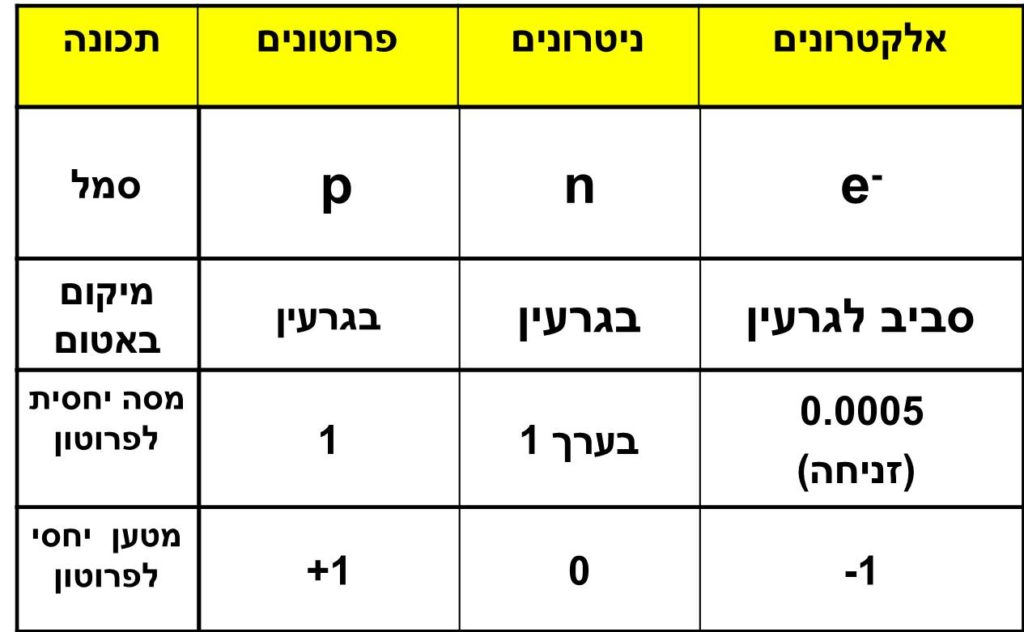
פרוטון הוא חלקיק בגרעין בעל יחידת מסה אחת ומטען חשמלי שהוא 1+ בקירוב.
נויטרון הוא חלקיק בגרעין בעל יחידת מסה אחת ומטען חשמלי 0 .
מתוך שתי ההגדרות של פרוטון ונויטרון ניתן להסיק שחלקיקים אלו הם בעלי מסה דומה אבל נבדלים זה מזה במטען החשמלי שלהם.
כוחות משיכה ודחייה חשמליים
בין הפרוטונים לבין עצמם פועל כוח דחייה.
בין האלקטרונים לבין עצמם פועל כוח דחייה.
בין פרוטון לאלקטרון פועל כוח משיכה.
מכאן שהפרוטון והאלקטרון שבאטום מקיימים את חוקי כוחות הדחייה והמשיכה אשר התגלו אצל המטענים החשמליים שנוצרו משפשוף מוט זכוכית ומשפשוף מוט גומי.
הטבלה המחזורית
מספר אטומי
ההבדלים בין יסודות הוא מספר הפרוטונים הנמצא בגרעין האטום
אטומים של יסודות שונים
שיר היסודות:
מתכות ואל מתכות
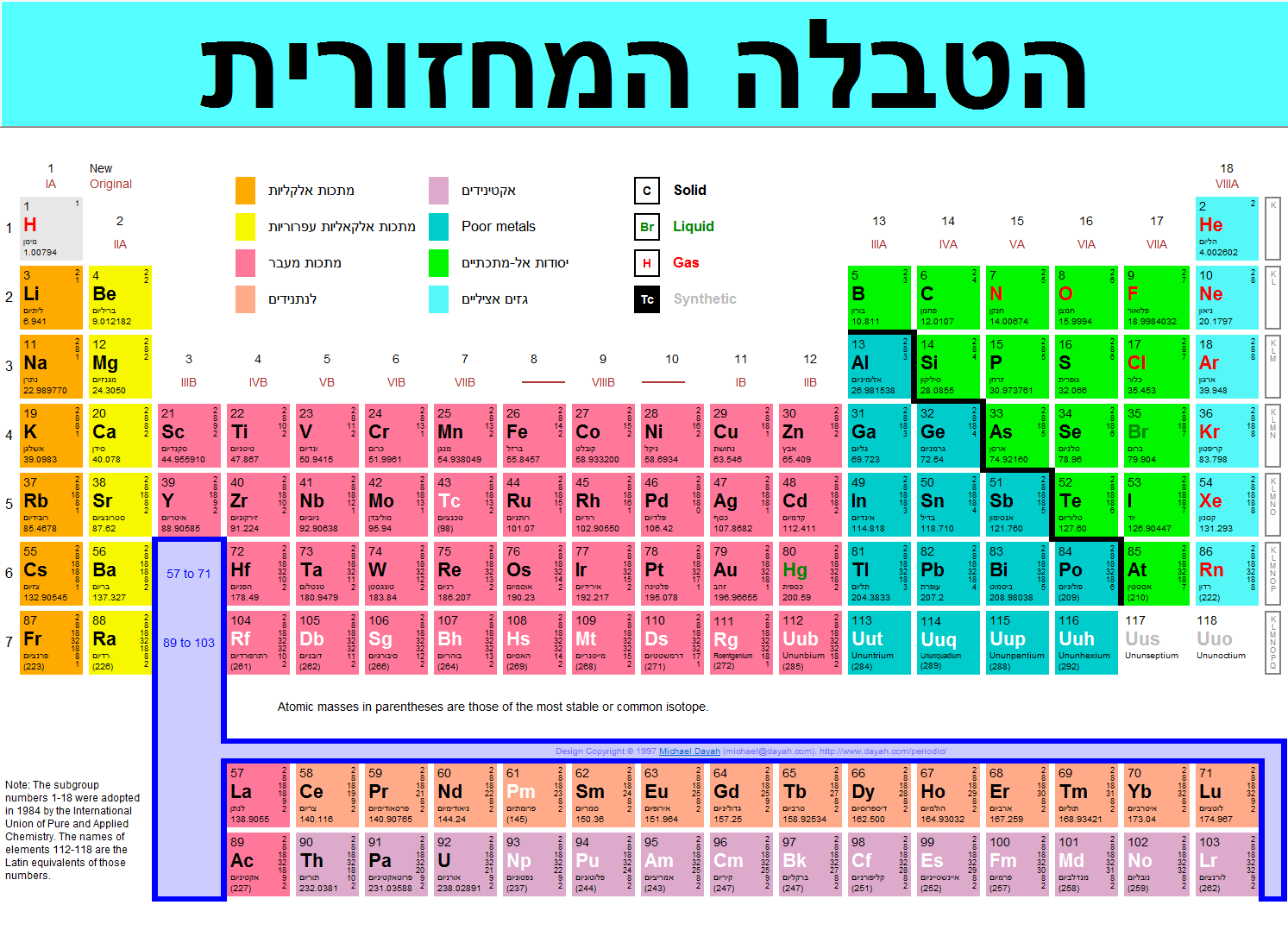
ל היסודות הנמצאים מצד ימין למדרגות שייכים לקבוצת האל מתכות.
כל היסודות הנמצאים מצד שמאל למדרגות שייכים לקבוצת המתכות.
תכונות המתכות:
· כולן במצב צבירה מוצק בטמפ' החדר (מלבד כספית שהיא נוזלית בטמפ' החדר).
· מוליכות חשמל
· מוליכות חום
· בעלות ברק
· ניתנות לריקוע
תכונות האל מתכות:
· יכולות להימצא בשלושת מצבי הצבירה במטפ' החדר (מוצק,נוזל,גז).
· לא מוליכות חום
· לא מוליכות חשמל
· לא בעלות ברק
· לא ניתנות לריקוע.
משפחות כימיות:
מתכות אלקאליות
משפחת ההלוגנים:
משפחת הגזים האצילים:
סימולציה- הרכבת אטומים
מיון חומרים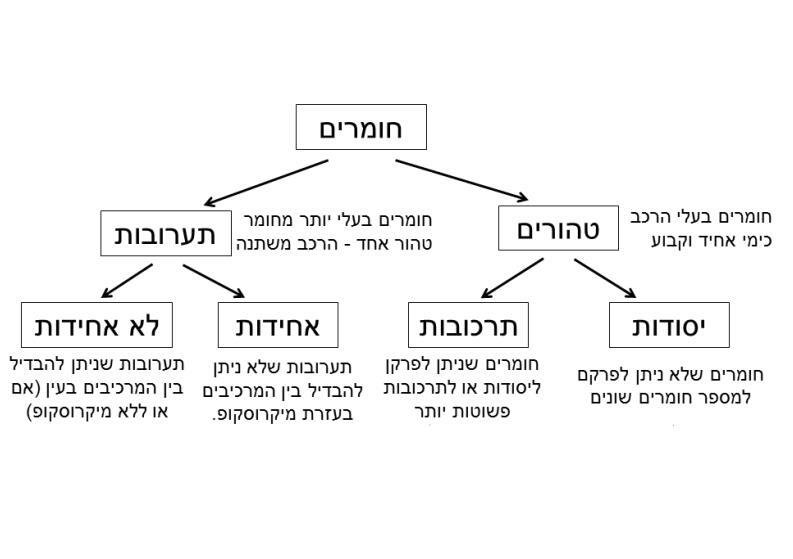 חומרים טהורים
חומרים טהורים
חומרים בעלי הרכב כימי אחיד וקבוע כלומר, אם ניקח דגימה כלשהי של החומר תמיד נצפה באותו חומר מבחינה תכונות כימיות ופיזיקליות. במקרה והחומר יכול להתפרק לחומרים שונים (לדוגמה על ידי חימום) תמיד נצפה באותם החומרים המשנה ובאותה יחס כמותית בין החומרים הללו.
ניתן להבדיל בין שני סוגי חומרים טהורים: יסודות ותרכובות.
יסודות : חומרים טהורים שאינם מתפרקים לחומרי משנה. לדוגמה: ברזל, חמצן, גופרית, אשלג. אלה היסודות שהכרנו בטבלה המחזורית. ניתן למיין יסודות לפי תכונות לשתי קבוצות: מתכות ואל מתכות. בהמשך הדף מתוארים כמה מאפיינים שלהן.
תערובת-
תערובת היא חומר שאינו טהור. תערובות מתקבלת בתהליך פיסיקלי של יצירה או הפרדה של חומרים. תערובת יכולה להיות אחידה (הומוגנית) או לא אחידה (הטרוגנית). שיטות הפרדה של תערובות מבוססות על תכונות ומאפיינים פיסיקלים של רכיבי התערובת. מידע על תערובות בקישורים הבאים.
שני חומרים (או יותר) מעורבבים, שאין ביניהם קשרים כימיים, ולכן כל אחד מהם שומר על תכונותיו.
ישנם 2 הבדלים חשובים בין תערובת לתרכובת: א. כל החומרים שמרכיבים את התערובת לא שינו את תכונותיהם. ב. בתערובת אפשר לשנות את היחס בין המרכיבים. דוגמה: האוויר הוא תערובת של גזים שונים: פחמן דו-חמצני, חנקן, חמצן
כלי עם פחמן דו-חמצני ומים- H2O + CO2
כלי עם פחמן דו-חמצני ומימן- H2 + CO2
כלי עם חמצן ומימן- H2 + O2
אולם כל גז שומר על תכונותיו המקוריות
הפרדת תערובות:
חומרי לימוד:
מבנה החלקיקים של חומרים טהורים ותערובות.ppt
דף עבודה- חומרים טהורים.docxתערובות ותרכובותמשימה1.docתרגול-תערובות.docx
מבנה האטום:
מבנה האטום סיכום.docמשפחות-כימיות לאתר.ppt
מבנה-האטום-חלק-א-כולל-משימה-א-סינכרונית.pptx
הסוד של האטום- מצגת עם שאלות חזרה
דף עבודה חוק שימור המסה 83-aOGOFlQPnj.docx
21-EoEDTNJgjT.pptx- מצגת חוק שימור המסה
7.-תהליכים-כימיים-פירוק-התרכבות-ובעירה.pptx
סיכום-סוגי-חלקיקים-ומבנה-האטום.doc
יונים
עד עכשיו דיברנו על האטום כאשר הוא נמצא במצב נייטרלי, כלומר הוא אינו טעון.
אבל אטומים יכולים להיות טעונים, מקרים כאלה נגרמים כאשר מספר האלקטרונים אינו שווה למספר הפרוטונים (באטום נייטרלי הם שווים, ולכן המטען החיובי מאפס את המטען השלילי).
מס' אלקטרונים שלא שווה למספר הפרוטונים יכול להיגרם כתוצאה מהוצאה של אלקטרון מאטום, כלומר האטום מסר אלקטרון. או כתוצאה מכך שאטום קיבל אלקטרון, כלומר מספר האלקטרונים גדל.
פירוש השם יון= אטום טעון.
מס' האלקטרונים≠ מס' הפרוטונים
אם:
מס' אלקטרונים > מס' הפרוטונים
מתקבל יון שלילי
אם:
מס' אלקטרונים < מס' הפרוטונים
מתקבל יון חיובי
סמל האטום | מס' אטומי | מס' מסה | מס' פרוטונים | מס' אלקטרונים | מס' ניוטרונים |
Li+ | 3 | 7 | 3 מספר פרוטונים שווה למספר האטומי | 3-1=2 ישנם 2 אלקטרונים | 7-3=4 |
O-2 | 8 | 16 | 8 מספר פרוטונים שווה למס' האטומי | 8+2=10 ישנם 10 | 16-8=8 |

סיכום-החומר-של-כיתה-ח (1).docx