
כימיה
הקדמה - חיים ללא כימיה
הסרטון שלפניכם מציג אדם החולם על עולם ללא כימיה.
האם לדעתכם ייתכן עולם כזה?
הקדמה - חיים ללא כימיה
הסרטון שלפניכם מציג אדם החולם על עולם ללא כימיה.
האם לדעתכם ייתכן עולם כזה?
שינוי כימי ושינוי פיזיקלי- מצגת בהמשך...
למדנו כי:
אטום- החלקיק הקטן ביותר השומר על תכונות החומר, ומרכיב את החומרים בעולם.
מולקולה- צירוף של 2 או יותר אטומים המחוברים זה לזה בקשר כימי.
יסוד- חומר הבנוי מאטומים מסוג אחד. (יסוד יכול להיות בנוי מאטומים בודדים או ממולקולות שבנויות מסוג אחד של אטומים)
תרכובת- חומר הבנוי מאטומים מכמה סוגים שונים.
מולקולה יכולה להיות מולקולה של תרכובת או מולקולה של יסוד.
מולקולה של יסוד- מולקולה הבנויה מאטומים מסוג אחד.
מולקולה של תרכובת- מולקולה הבנויה מסוגים שונים של אטומים.
הטבלה המחזורית של מנדלייב מכילה כ100 יסודות שונים הנמצאים על פני כדור הארץ.
את היסודות מסמנים בשפה הכימית באות גדולה.
דוגמאות:
מימן H
חנקן N
חמצן O
אם ישנם כמה יסודות המתחילים באותה אות, נהוג לתת ליסוד שמופיע קודם את האות הראשונה של שמו, וליסוד שמופיע אחריו לתת אות שנייה קטנה לאחר האות הגדולה.
דומגה:
מימן בא לפני הליום לכן:
מימן H
הליום He
דוגמה נוספת:
חנקן בא לפני נאון לכן:
חנקן N
נאון Ne
כשרוצים לכתוב מולקולות יש צורך לכתוב את מספר האטומים שמשתתפים בכל מולקולה, מספר זה יבוא בקטן ומצד ימין לאטום שהוא שייך לו.
לדוגמה:
מולקולה שבנוייה מ2 אטומי חמצן: O2
מולקולה שבנויה מאטום פחמן אחד ו-4 אטומי מימן: CH4
את מספר המולקולות יש לכתוב מצד שמאל למולקולה, לדוגמה:
5 מולקולות של מים- 5H2O
7 מולקולות של אוזון (אוזון מורכב מ-3 אטומי חמצן)- 7O3
את מספר האטומים הבודדים גם רושמים מצד שמאל לאטומים, אבל אין לרשום מספרים קטנים מצד ימין.
לדוגמה: 5 אטומי חמצן 5O
10 אטומי גופרית 10S
50 אטומי מימן 50H
שפה כימית.ppt
ממבנה האטום
סיכום השפה הכימית
שינוי כימי -
שינוי פנימי של החומר, גורם ליצירת חומר חדש בעל תכונות שונות. במהלך השינוי הכימי, הקשרים בין אטומי החומר מתנתקים ונוצרים מחדש בצורה שונה (כך נוצר חומר חדש).
דוגמה לתגובה כימית: פירוק של תרכובת ליסודות שלה - פירוק מים באמצעות חשמל:
הקשר הקוולנטי- קשר שיתופי
אנרגיה כימית מצגתכיתה ט כימית.pdf
קשר קוולנטי
במילה קוולנטי שני חלקים:
- קו – (co) שיתוף
- וולנטי – (valent) ערכי
ביחד: שיתוף אלקטרונים ערכיים.
הקשר הקוולנטי נוצר בעיקר בין אטומים השייכים לקבוצת האל-מתכות בטבלה המחזורית.
נתבונן בטבלה המחזורית:
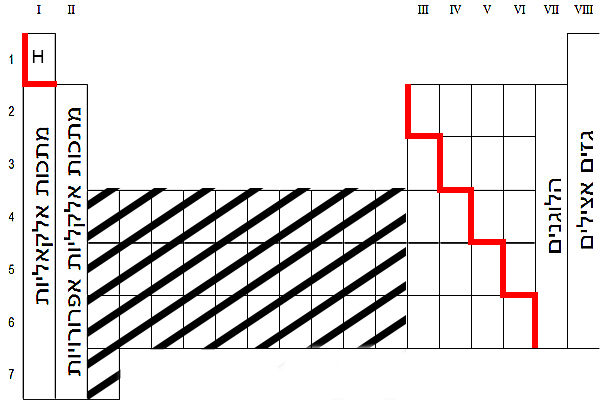
קבוצת האל-מתכות נמצאת מימין לקו האדום ואינה כוללת את הגזים האצילים (טור VIII). אטום המימן שייך גם הוא לקבוצת האל-מתכות.
ניזכר במה שכבר למדנו במיון חומרים: מרב היסודות ששייכים לקבוצה זו – המימן, החנקן, החמצן, הפלואור, הכלור, הברום והיוד – בנויים ממולקולות דו-אטומיות. עוד למדנו שהגופרית והזרחן הם יסודות שמופיעים בטבע כמולקולות רב-אטומיות. כל היסודות שהזכרנו בנויים מאטומי אל-מתכות היוצרים קשר קוולנטי זה עם זה. למעשה זהו קשר שבו כל אחד מהאטומים משתף אלקטרון/אלקטרונים ערכיים.
מושג נוסף משיעור היערכות אלקטרונים הוא אורביטל. זהו אזור מסביב לגרעין האטום שבו הסיכוי למצוא אלקטרון או אלקטרונים גדול. צורת האורביטל מתקבלת מפונקציה מתמטית מורכבת.
אז מה קורה בזמן יצירת קשר קוולנטי?
נזכיר שבכל אטום ישנם אלקטרונים. האלקטרונים נמצאים ברמות אנרגיה שונות באורביטלים שלהם. אורביטלים אלו נקראים אורביטלים אטומיים כי הם שייכים לאטום אחד בלבד.
כששני אטומים נקשרים ויוצרים קשר קוולנטי, נוצרת חפיפה בין האורביטלים האטומיים, בדרך-כלל החיצוניים ביותר, המכילים את אלקטרוני הערכיות. כתוצאה מהחפיפה נוצרים אורביטלים מולקולריים.
אורביטל מולקולרי מוגדר כאזור שבו נמצאים אלקטרונים משותפים לשני אטומים או יותר בקשר כימי. מכיוון שאנו דנים בקשר קוולנטי, אורביטל מולקולרי יהיה האזור שבו יש סיכוי למצוא את האלקטרונים המשותפים, השייכים לשני אטומים הקשורים בקשר קוולנטי. גם כאן יש מקרים מורכבים יותר שלא נדון בהם.
בעקבות השיתוף בין האטומים השונים, נוצרות מולקולות, הן של יסוד – המורכבות מסוג אחד של אטומים – הן של תרכובות – המורכבות מאטומים של יסודות שונים – שרמת האנרגיה האחרונה שלהם מלאה. מצב זה דומה לרמת האנרגיה האחרונה המואכלסת באלקטרונים של גז אציל הנמצא באותה שורה עם האטום של היסוד או בשורה מעליה, תלוי בסוג הקשר הכימי. באופן זה, מתקיימת יציבות כימית שבאה לידי ביטוי בשינויי אנרגיה שמלווים את יצירת הקשרים הכימיים. נדון בשינויים אנרגטיים אלו במועד מאוחר יותר.
בדוגמה הבאה ננסה להבין באופן מפורט יותר מה קורה בזמן יצירת קשר קוולנטי בין שני אטומי מימן. מה בעצם קורה כשאטום מימן פוגש אטום מימן נוסף?
לשם כך, ניזכר בהיערכות האלקטרונים של אטום המימן ובמבנה החלקיקי שלו.
לאטום המימן שלושה איזוטופים שלכולם אותה התנהגות כימית. נזכיר שמה שקובע את ההתנהגות הכימית הוא המבנה האלקטרוני ואלקטרוני הערכיות, ולא מספר הניוטרונים שבגרעין.
האיזוטופ הנפוץ ביותר הוא: הוא מורכב מאלקטרון אחד ופרוטון אחד. ההיערכות האלקטרונית שלו היא:
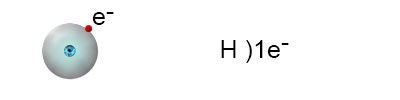
כדי להגיע למצב שבו רמת האנרגיה החיצונית מלאה, המימן צריך להוסיף אלקטרון אחד לרמה זו. יש לזכור, שלפי כלל האוקטט, ברוב המקרים, הרמה החיצונית של האטום תתמלא בעקבות יצירת קשר כימי בשמונה אלקטרונים. מכיוון שלמימן יש רק רמת אנרגיה אחת, היא יכולה להתמלא רק ב-2 אלקטרונים.
כששני אטומים מתקרבים זה לזה, נוצרת מערכת של דחיות ומשיכות של מטענים חשמליים בין החלקיקים (פרוטונים ואלקטרונים) של האטום האחד לחלקיקים של האטום השני. אלקטרון מאטום מימן אחד נמשך גם לגרעין שלו, אבל גם לגרעין של האטום השני, שכן, שניהם מכילים פרוטון חיובי. במקביל, נוצרת גם דחייה בין האלקטרונים של שני האטומים כי הם טעונים במטענים שליליים וגם בין הפרוטונים של שני האטומים כי הם טעונים במטענים חיוביים. דבר דומה קורה גם לאלקטרון של האטום השני. כלומר, ישנה מערכת של דחיות ומשיכות של מטענים חשמליים. ככל שהמרחק בין האטומים קטן, מערכת הדחיות והמשיכות מתגברת. להזכירכם, לפי חוק קולון ככל שמטענים חשמליים קרובים זה לזה, גם הדחייה (אם המטענים זהים) וגם המשיכה (אם המטענים שונים) מתגברות.
כעת ניגש לתוצאה הסופית. ידוע לנו שהמימן קיים בטבע כמולקולה דו-אטומית, כלומר כמולקולה שבה שני אטומי מימן קשורים זה לזה. ניתן לקבוע שסך כל המשיכות בין המטענים החשמליים גדול מסך כל הדחיות בין המטענים החשמליים ולכן נוצר הקשר הכימי בין שני אטומי מימן.
הקשר שנוצר בין שני האטומים הוא קשר קוולנטי. זהו קשר בין שני אטומים שבו כל אחד מהאטומים משתף אלקטרון אחד. עקב השיתוף, נוצר אורביטל מולקולרי אזור מרחבי חדש שבו נמצאים זוג האלקטרונים המשותפים לשני אטומי המימן. האלקטרונים המשותפים נמשכים על-ידי שני הגרעינים החיוביים של אטומי המימן.
היווצרות קשר קוולנטי הדמיה
איזון תגובות כימיותקשרים כימיים ואיזון תגובות.ppt
תרכובות הפחמן
פחמן הוא היסוד השלישי הנפוץ ביותר בגוף האדם, אחרי חמצן ומימן. מבנה האטום ותכונותיו גוזרים את חשיבותו העצומה במערכת החי.
אלוטרופיה של פחמן:
הפחמן מופיע בטבע בצורות שונות הנקראות צורות אלוטרופיות. כל הצורות האלוטרופיות מורכבות מאטומי פחמן בלבד הקשורים זה לזה בקשרים קוולנטיים, אך הן נבדלות זו מזו במבנה הגאומטרי שלהן, במספר הקשרים הקוולנטיים שיוצר כל פחמן בחומר, ולפיכך גם בתכונות וביישומים השונים של כל צורה אלוטרופית. שתי הצורות המוכרות ביותר הן גרפיט (ממנו עשוי החוד של העיפרון והוא גם נמצא בשימוש בסוללות) והיהלום. הגרפיט מורכב משכבות של גרפן, צורה אלוטרופית של פחמן שבה כל אטום פחמן יוצר שלושה קשרים קוולנטיים עם אטומי פחמן סמוכים. מכיוון שנשאר אלקטרון ערכיות אחד שאינו משתתף בקשר כימי, קיימים בחומר אלקטרונים חופשיים הנעים בין השכבות ויכולים להוליך זרם חשמלי כאשר מחברים את החומר למקור מתח חיצוני. המבנה המרחבי של יהלום הוא גביש מסודר שבו כל אטום פחמן קשור לארבעה אטומי פחמן נוספים בקשר קוולנטיים. המבנה צפוף מאוד, דבר המסביר את החוזק הרב של החומר. מכיוון שאין אלקטרוני ערכיות חופשיים במבנה של היהלום, היהלו אינו מוליך זרם חשמלי.
שתי צורות נוספות של אלוטרופים הן: ננו־צינוריות פחמן (carbon nanotubes) ופולרן (C60). הננו־צינוריות הן למעשה שכבות של גרפן שמקופלות ל
צורה של צינוריות, כאשר אפשר לשלוט על האופן שבו שכבת הגרפן מתקבלת ליצירת הצינורית ולקבל תכונות שונות של החומר. הפולרן מזכיר במבנה שלו כדורגל והוא כדור המורכב מטבעות מחומשות ומשושות של פחמנים. כל פחמן בפולרן קשור לשלושה אטומי פחמן נוספים , כך שבדומה לגרפן, גם הפולרן מוליך זרם חשמלי.
אוריינות מדעית - כימיה פחמן.docx
פחמן מצגת העלו את המשימה על יסוד הפחמן לקישור הבא:
פחמימות (סוכרים)
הפחמימות הן התרכובות האורגניות הנפוצות ביותר על פני כדור הארץ. אחד התפקידים העיקריים של הפחמימות (סוכרים) הוא אספקת אנרגייה לתהליכים בגוף.
אפשר למיין את הסוכרים לשלוש קבוצות עיקריות:
- חד־סוכרים. לדוגמה: גלוקוז
- דו־סוכרים. לדוגמה: סוכרוז
- רב־סוכרים. לדוגמה: עמילן

חד־סוכרים הם יחידות הבניין הבסיסיות של הפחמימות. החד־סוכרים מורכבים מטבעות מחומשות או משושות המכילות שישה פחמנים. החד־סוכרים מסיסים במים. גלוקוז הוא דוגמה לחד־סוכר והוא מקור האנרגייה הזמינה של הגוף. מכיוון שחד־סוכרים מסיסים במים, המולקולה יכולה לחדור אל תאי הגוף, להתמוסס בהם ולהשתתף בתהליך הנשימה התאית. כאשר הקשרים הכימיים של הגלוקוז מתפרקים, משתחררת אנרגייה שמשמשת את תאי הגוף.

כתגובה בין שני חד־סוכרים משתחררת מולקולת מים, והתוצאה היא דו־סוכרים. הקשר בין הסוכרים נקרא גם קשר גליקוזידי.
אפשר לזהות חד־סוכרים ודו־סוכרים על ידי ריאגנט בנדיקט רק אם הפחמן נמצא בשיווי משקל עם הצורה האלדהידית שלו (פחמן כזה נקרא גם פחמן מחזר).
רב־סוכרים הם פולימרים הבנויים מיחידות רבות של חד־סוכר המחוברות זו לזו. ביחידה זו נדון בכמה דוגמאות

לרב־סוכרים כמו: עמילן, הבנוי משרשראות ארוכות של גלוקוז הקשורות בקשרים גליקוזידיים ומשמש חומר תשמורת בצמחים, גליקוגן המשמש כחומר תשמורת בגוף האדם (בכבד ובשרירים), ותאית (צלולוז) המשמשת חומר מבנה בצמחים.
הרב־סוכרים מסיסים פחות במים. תכונה זו בצירוף גודלם אינם מאפשרים להם לחדור לתאי הגוף. כאשר הגוף זקוק לאנרגייה זמינה, מולקולות הענק האלה מתפרקות ליחידות הבניין שלהן.
זיהוי גלוקוז נעשה באמצעות תמיסת בנדיקט וחימומה בנוכחות חד־סוכרים (כמו גלוקוז). בתגובה זו התמיסה משנה את צבעה מכחול לכתום. זיהוי עמילן מתבצע באמצעות תגובה עם יוד, שכן היוד והעמילן יוצרים קומפלקס בצבע כחול כהה הניתן לזיהוי בקלות.
אפשר להבחין בין חד־סוכרים ודו־סוכרים לבין רב־סוכרים גם בעזרת חוש הטעם. חד־סוכרים ודו־סוכרים הם בעלי טעם מתוק, ואילו רב־סוכרים אינם בעלי טעם מתוק.
להרחבה נוספת מומלץ להיעזר בספר "טעם של כימיה" (הוצאת יסוד) בפרק העוסק בסוכרים ובפחמימות.
חלבונים
בדומה לפחמימות ושומנים, החלבונים מורכבים מפחמן (C), מימן (H) וחמצן (O), בשונה מהפחמימות ומהשומנים, החלבונים מכילים גם חנקן (N) וחלקם מכילים גם גופרית (S). החלבונים הם פולימרים הבנויים משרשרת של חומצות אמינו הקשורות זו לזו ומהוות את אבני הבניין שלהם. לכל חומצות האמינו מבנה כללי דומה וחלק נוסף, שונה וייחודי המבדל את חומצות האמינו זו מזו.

מבנה החומצה האמינית הוא פחמן מרכזי שאליו מחוברות ארבע קבוצות אטומים שונות: קבוצה אחת היא מימן, קבוצה שנייה היא חומצה קרבוקסילית (COOH), קבוצה שלישית היא אמין (NH2), מכאן שמה של החומצה האמינית, וקבוצה רביעית המשתנה מחומצה אמינית אחת לאחרת. המבנה הכללי של חומצת אמינו מתואר בתמונה, והאות R מייצגת את הקבוצה המשתנה מחומצה אמינית זו לזו.
קיימות כ־20 חומצות אמינו. חומצות האמינו יכולות להתחבר זו לזו. הקשר נעשה בין קבוצה קרבוקסלית (COOH) של חומצה אמינית אחת לבין הקצה האמיני (NH2ׂ) של חומצה אמינית אחרת. קשר זה נקרא קשר פפטידי. החומצות האמיניות מתחברות זו לזו ויוצרות שרשראות ארוכות. שרשראות אלה מרכיבות את החלבונים.
החלבונים שונים זה מזה באורך השרשראות שנוצרות, בהרכב השרשראות ובסדר החומצות בשרשרת. מקובל לדמות את חומצות האמינו לאותיות הא"ב, שבעזרתן אפשר ליצור אינספור מילים, כאשר המילים נבדלות ביניהם בסוג האותיות במילה, במספר האותיות ובסדר האותיות. כפי שאפשר ליצור מילים רבות באמצעות האותיות, אפשר ליצור מספר אינסופי של חלבונים.
בין חומצות האמינו בשרשראות היוצרות את החלבון נוצרים קשרים בין אטומים שונים שאינם סמוכים. קשרים אלה מביאים להיווצרות מבנה מרחבי של החלבון. לשרשראות מסוגים שונים מבנים מרחביים אופייניים. המבנים המרחביים של החלבונים מאפשרים לחלבונים לשמש כמבצעי פעולות שונות בגוף היצור החי. לחלבונים תפקוד חשוב בגוף החי. קיימים חלבוני מבנה, כגון חלבונים הנמצאים בקרום התא. חלבונים אלה משמשים לבניית אברוני התא ולבניית שרירים ורקמות נוספות בגוף. חלבונים אחרים נקראים חלבוני פעולה. חלבונים אלה אחראים על תהליכים בגוף, כגון נוגדנים, הורמונים, אנזימים ועוד. את נוכחות החלבון במזונות שונים מזהים באמצעות תמיסת ביורט המשנה את צבעה מתכלת לסגול בנוכחות חלבונים. תגובה זו מאפשרת לגלות גם את ריכוז החלבונים.
שומנים
לשומנים חשיבות גדולה והם בעלי תפקידים רבים ביצורים החיים. הם מרכיבים חומרים שונים בגוף כמו הורמונים מסוימים, מסייעים בשמירה על טמפרטורת הגוף בכך שהם מבודדים חום, מגנים על איברים פנימיים מפני פגיעה, מרכיבים את קרום התא, חלקם משמשים כחומרי תשמורת להפקת אנרגייה בשימוש עתידי ועוד.
תכונתם המשותפת והבולטת היא שהם אינם מסיסים במים.
השומנים נחלקים לשתי קבוצות: שומנים שהם מוצקים בטמפרטורת החדר ושמנים שהם נוזלים בטמפרטורת החדר.
השומנים הנפוצים ביותר בגופם של היצורים החיים מורכבים מיחידות בניין הנקראות חומצות שומן.
חומצות השומן שונות זו מזו באורך השרשרת הפחמימנית ובמספר הקשרים שבין הפחמנים (קשר יחיד או קשר כפול). כאשר השרשרת הפחמימנית אינה מכילה קשרים כפולים החומצה נקראת רוויה. הכוונה היא שהיא רוויה במימנים.חומצת שומן המכילה קשר כפול אחד (בין פחמן לפחמן) בשרשרת נקראת חומצת שומן חד לא רוויה. אם יש כמה קשרים כפולים, החומצה נקראת חומצת שומן רב לא רוויה.

שאלות חזרה למבחן פחמן ותרכובותיו
שאלות חזרה למבחן בכימיה בנושא הפחמן תרכובותיו.docx
